Bruk av Share-FI til å avdekke skrøpelegheit ved kognitiv svikt
Bakgrunn: Skrøpelegheit er ein tilstand der aldersrelaterte endringar gjer eldre meir sårbare for sjukdom og skade. På lik linje med skrøpelegheit aukar førekomst av demens med alderen. Studiar gjev støtte til at skrøpelegheit og demens kan ha ein gjensidig negativ innverknad på kvarandre.
Hensikt: Undersøke om Survey of Health, Ageing and Retirement in Europe – Frailty Instrument (Share-FI), eit screeningverktøy for skrøpelegheit, er eigna til å avdekke skrøpelegheit hjå eldre dersom ein vil ta omsyn til kognisjon.
Metode: Ein tverrsnittstudie frå eit samtykkebasert kvalitetsregister i ein eldremedisinsk poliklinikk blei utført, med 184 personar over 70 år som var til utgreiing på poliklinikken for kognitiv svikt eller fallutgreiing. Vi kartla fysisk og kognitiv funksjon med validerte målemetodar. Assosiasjonar mellom sumskåren på Share-FI og ulike testar for kognisjon (Mini-mental statusevaluering [MMSE], Trailmaking A og B og klokketest) vart undersøkt med Spearmans korrelasjonskoeffisient (rank test). Sekundært undersøkte vi også assosiasjonar mellom enkeltkomponentar i Share-FI og ulike testar for kognisjon.
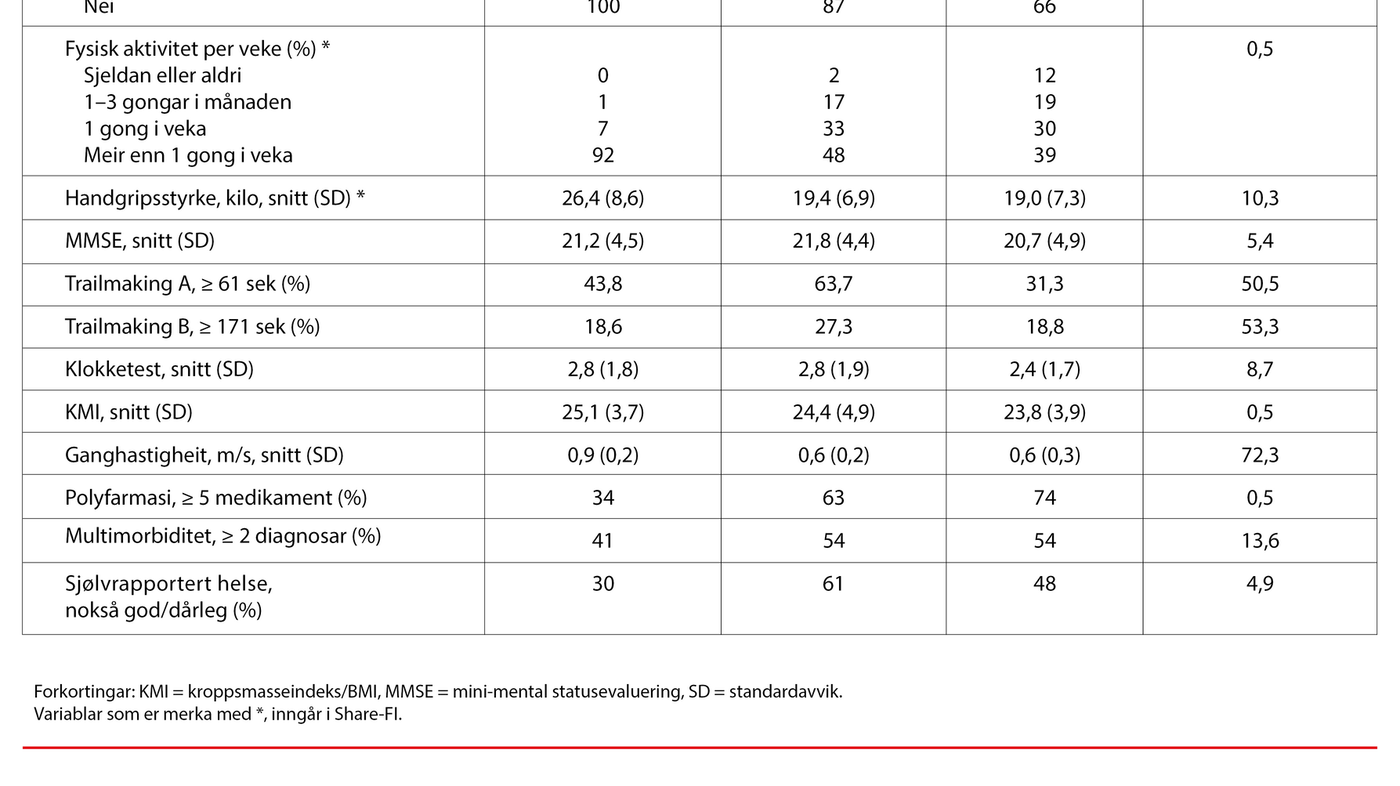
Resultat: Storparten av pasientane i studien var tilvist for utgreiing av demens. Hundre personar (54 prosent) var rekna som ikkje-skrøpelege, medan 84 personar (46 prosent) var rekna som anten skrøpelege eller preskrøpelege. Gjennomsnittsalderen var relativt lik i dei tre gruppene. Det var trivielle korrelasjonar mellom sumskåren på Share-FI og dei kognitive testane (p-verdiar frå 0,322–0,824). Av einskildkomponentane i Share-FI var låg fysisk aktivitet assosiert med dårlegare skår på MMSE og klokketest, medan unormal appetitt var assosiert med dårlegare skår på Trailmaking B, men korrelasjonane var små til moderate (p-verdiar < 0,05).
Konklusjon: Sumskåren på Share-FI som eit mål på skrøpelegheit var ikkje assosiert med kognitive testar og ser difor ikkje ut til å vere spesielt godt eigna til å avdekke skrøpelegheit dersom ein vil ta omsyn til kognisjon.
Referer til artikkelen
Endal G, Søvde B, Terum T, Søgnen E, Andersen J. Bruk av Share-FI til å avdekke skrøpelegheit ved kognitiv svikt. Sykepleien Forskning. 2023; 18(92075):e-92075. DOI: 10.4220/Sykepleienf.2023.92075
Introduksjon
I Noreg så vel som internasjonalt blir det stadig fleire eldre. Politiske føringar peikar på at eldre skal bu lengst mogleg i eigen heim, og eldre som lever med skrøpelegheit, er ei av fire prioriterte grupper i Nasjonal helse- og sjukehusplan (1).
Skrøpelegheit viser til aldersrelaterte endringar som gjer eldre meir sårbare for sjukdom og skade, og er assosiert med langtidsopphald på institusjon, sjukehusinnlegging og kortare levetid (2–5). Førekomsten av skrøpelegheit aukar gradvis med alderen, og rammar omtrent 10 prosent av personar som er 65 år og eldre (4, 6) og 65 prosent av personar over 90 år (7).
På lik linje med skrøpelegheit aukar førekomsten av demens med alderen (8). Wyller og Hem (9) har framheva viktigheita av å identifisere skrøpelegheit, fordi det indikerer behov for tilrettelagt og tilpassa behandling.
Det finst ingen einsarta definisjon på skrøpelegheit eller semje om korleis ein identifiserer skrøpelegheit hjå eldre. Fried og medarbeidarar (2) klassifiserer pasientar som skrøpelege dersom dei oppfyller tre av følgande fem kriterium: utilsikta vekttap, sjølvrapportert utmatting, mangel på energi, låg ganghastigheit og svak gripestyrke.
Fried sin fenotypemodell (2) femnar berre om fysiske mål på skrøpelegheit, trass i at fleire peikar på at skrøpelegheit og demens kan ha ein gjensidig negativ påverknad på kvarandre (5, 10–12). Den kumulative modellen til Rockwood og medarbeidarar (3) er derimot meir omfattande og definerer skrøpelegheit som summen av negative faktorar, inklusive kognitiv funksjon.
Survey of Health, Ageing and Retirement in Europe – Frailty Instrument (Share-FI) er eit anerkjent kartleggingsverktøy både i forsking og klinisk praksis. Share-FI baserer seg på Fried sin fenotypemodell (2, 13) og seier difor ingenting om kognitiv funksjon. Share-FI har vist seg å vere ein god prediktor for dødelegheit (13).
Ifølgje Danilovich og medarbeidarar (14) er Share-FI godt eigna til å identifisere personar som er skrøpelege, då dei skårar signifikant dårlegare på objektive fysiske målingar samanlikna med dei som blir rekna som ikkje-skrøpelege. Det er meir usikkerheit knytt til gruppa preskrøpelege. Ei svakheit ved studien er at dei ikkje inkluderte mål på kognitiv funksjon.Same forfattar fann i ein seinare studie at objektive data kan vere meir sensitive enn sjølvrapporterte data som i Share-FI for å avdekke skrøpelegheit (15).
Dette samsvarer med funn i O’Caoimh og medarbeidarar (16) sin studie, som samanlikna screeningverktøy for skrøpelegheit. Dei fann at sjølvrapporterte data kan vere mindre presise, særleg blant personar med demens. Nyare verktøy brukt til å kartlegge skrøpelegheit tek i større grad høgde for samanhengen mellom kognisjon og skrøpelegheit (17), og ein kan også stille spørsmål ved om desse omgrepa eigentleg er overlappande.
Ved ein geriatrisk poliklinikk vart Share-FI prøvd ut som mål på skrøpelegheit, som eit ledd i utgreiing av kognitiv svikt og funksjonsvurdering for personar over 70 år. På bakgrunn av dette arbeidet stilte vi spørsmål om Share-FI er eigna til å avdekke skrøpelegheit hjå eldre dersom ein også skal ta omsyn til kognitiv svikt. Vi undersøkte difor om skår på Share-FI var assosiert med objektive målingar av kognisjon.
Metode
Studien baserer seg på tverrsnittdata frå eit samtykkebasert eldremedisinsk kvalitetsregister i Helse Førde, som vart godkjent av føretaket sitt personvernombod (PVO). Data blei samla inn i perioden 2016–2020. Studien blei utført i tråd med retningslina STROBE for observasjonsstudiar.
Vi inkluderte 184 pasientar, og dette er 86 prosent av alle pasientar som har vore utgreidd på poliklinikken for fall, demens eller førarkortvurdering. Dei andre pasientane vart vurdert til ikkje å vere samtykkekompetente, og desse har vi ingen demografiske eller kliniske data om.
Datamaterialet vart anonymisert etter avslutta datainnsamling. Dette vart gjort i samarbeid med PVO og er i samsvar med opplysingane som vart gitt til pasientane før dei samtykte. Studien er dermed ikkje meldepliktig.
Variablar og målemetodar
Alle pasientane vart vurdert av eit fast team beståande av lege, ergoterapeut og geriatrisk sjukepleiar. Pasientane vart vurdert av legen, ergoterapeuten gjennomførte kognitive testar, medan geriatrisk sjukepleiar utførte dei andre målingane. Det er éin person som har lagt inn alle målingar i registeret.
Demografiske data inkluderer alder (år), kjønn (kvinne, mann), sivilstatus (gift/sambuar: ja/nei) og om vedkommande bur heime (ja/nei).
Skrøpelegheit vart undersøkt med Share-FI, som baserer seg på sjølvrapportering av symptom og funksjon (overskot, appetitt, gangfunksjon, fysisk aktivitet) og ei objektiv handgripsmåling (13). Utfylling av Share-FI var assistert av geriatrisk sjukepleiar. Handgripsstyrke vart målt to gongar i kvar arm med eit handdynamometer, og den høgaste verdien vart nytta i analysar.
Kvar pasient fekk ein kjønnsspesifikk Share-FI-sumskår, basert på eit vekta skåringssystem som er knytt til risiko for mortalitet, og vart klassifisert som ikkje-skrøpeleg, pre-skrøpeleg eller skrøpeleg. Vi baserte Share-FI-skåringane på ein Excel-kalkulator som er lagt til som vedlegg til originalartikkelen (15).
Kognisjon vart undersøkt med Mini-mental statusevaluering (MMSE) (18). MMSE er eit screeningverktøy for kartlegging av kognitive funksjonar på områda hukommelse, orienteringsevne, språkforståing og visuokonstruksjon. MMSE gir ein kontinuerleg skår frå 0–30, der høgare verdi er best skår. Sumskår < 24 poeng kan indikere kognitiv svikt.
Trail Making Test (TMT) A og B (19), som på norsk kanskje kan omsetjast til «løypeleggingstest», blei brukt for å måle merksemd, tempo og eksekutiv funksjon. I TMT-A teiknar personen så raskt som mogleg strek mellom tala 1–25 i stigande rekkefølge. I TMT-B teiknar personen så raskt som mogleg strek vekselvis mellom tal og bokstavar, 1–A til 13–L. Ein skår på ≥ 61 sekundar på Trailmaking A og ≥ 171 sekundar på Trailmaking B indikerer mogeleg redusert kognisjon.
Klokketesten (20), der pasienten teiknar ei analog klokke med eit gitt klokkeslett, vart brukt til å kartlegge personen si evne til planlegging og visuokonstruktiv hukommelse. Han stiller krav til merksemd, talforståing og semantisk hukommelse (21). Klokketestskalaen går frå 0–5, der høgaste verdi er best skår, og ein skår på ≤ 3 indikerer redusert kognisjon.
Kroppsmasseindeks (KMI eller BMI) vart målt med kroppsvekt i kilo / (kroppshøgde i meter x kroppshøgde i meter). KMI < 22,5 kan tyde på auka risiko for nedsett helse hos eldre (22). Talet på medikament vart definert som talet på legemiddel ein pasient stod fast på, og polyfarmasi vart definert som ≥ 5 medikament.
Talet på diagnosar baserte ein på ei liste med sjukdommar som vart registrert i kvalitetsregisteret: hjartesvikt, koronarsjukdom, hypertensjon, hjerneslag, atrieflimmer, kols, parkinson, depresjon, nyresjukdom og diabetes. Multikomorbiditet vart definert som ≥ 2 sjukdommar (23).
Gangfunksjon vart målt ved å kartlegge ganghastigheit. Ei ganghastigheit < 0,8 meter per sekund vert gjerne definert som låg (24, 25). Gripestyrke i kilo vart målt med eit handdynamometer, JAMAR (2). Verdiar på < 27,5 hos menn og < 18 hos kvinner vert ofte rekna som låge hos eldre.
Sjølvrapportert global helse vart målt med eit spørsmål frå Helseundersøkinga i Nord-Trøndelag (HUNT). Ordlyden er: «Korleis er helsa di no?», med svarkategoriane «dårleg», «ikkje heilt god», «god» og «svært god» (26).
Analyse
Deskriptiv statistikk vart brukt for å beskrive utvalet. For å beskrive kontinuerlege variablar brukar ein gjennomsnitt og standardavvik, og for å beskrive andre variablar blir frekvens (prosent) brukt. Hovudanalysen var om Share-FI-skåren var assosiert med variablar som indikerer skrøpelegheit knytt til kognisjon. Men vi gjorde også sensitivitetsanalysar for å undersøke om Share-FI-skåren var assosiert med variablar som reflekterer mest fysisk helse (KMI, ganghastigheit, tal på medikament, tal på diagnosar og sjølvrapportert helse).
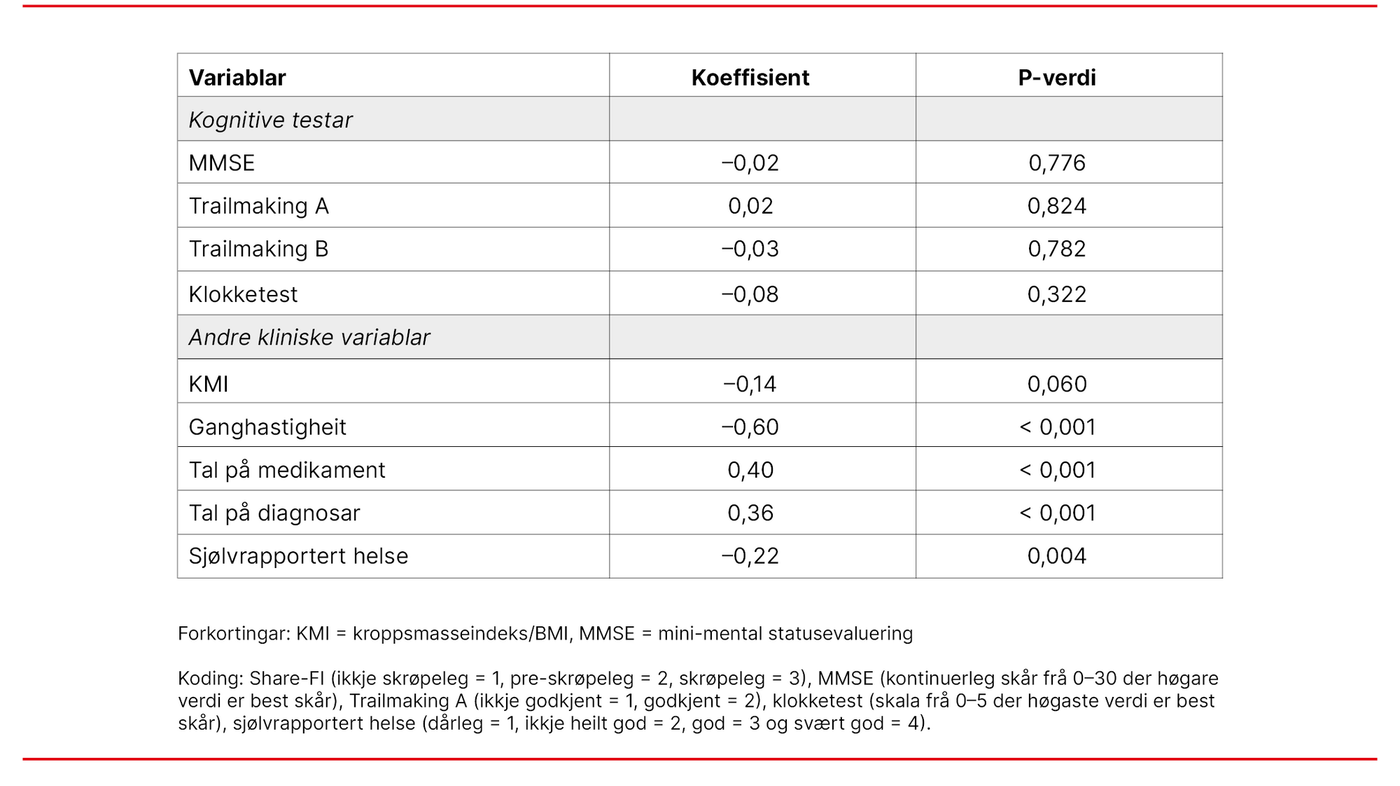
Spearmans korrelasjonskoeffisient vart nytta for å undersøke om Share-FI var assosiert med MMSE, Trailmaking A og B og klokketest, og deretter KMI, tal på medikament, tal på diagnosar, gangtest og sjølvrapportert helse. Vi koda Share-FI slik: ikkje-skrøpeleg = 1, pre-skrøpeleg = 2 og skrøpeleg = 3. Justering for kjønn er innebygd i denne skåringa. Korrelasjonar på < 0,2 vart rekna for å vere så låge at dei hadde ingen eller liten praktisk relevans, korrelasjonar på 0,20–0,29 indikerte ein middels relevans, medan korrelasjonar på ≥ 0,3 indikerte betydeleg praktisk relevans (27).
Vi undersøkte også om einskildspørsmål eller -målingar som inngår i Share-FI, var assosiert med andre indikatorar for kognisjon, fysisk helse og sjølvrapportert helse med Spearmans korrelasjonskoeffisient. Tosidige p-verdiar vart rapporterte som kontinuerleg indikator for usikkerheit knytt til resultata. Vi justerte ikkje for multippel testing, då dei fire måla for kognisjon i primæranalysen reflekterer ulike aspekt ved same konstrukt. Dette er fordi resten av korrelasjonane var sekundæranalysar, og vi definerte effektorleiksverdiar for korrelasjonane (27, 28). SPSS versjon 26 vart brukt i dei statistiske analysane.
Resultat
Totalt 185 pasientar deltok i studien, men grunna manglande data på Share-FI vart éin pasient ekskludert. Gjennomsnittleg alder var 81,2 år, der 52,9 prosent var kvinner. Tabell 1 syner pasientkarakteristika stratifisert på Share-FI-kategoriar.
Storparten av pasientane var tilvist primært for utgreiing av demens, og klassifisert som skrøpelege (n = 44), pre-skrøpelege (n = 40) og ikkje-skrøpelege (n = 100). Det var låge og ikkje-signifikante korrelasjonar mellom dei fire indikatorane for kognisjon og Share-FI (tabell 2), med p-verdiar frå 0,322 til 0,824. Det var derimot betydelege og signifikante assosiasjonar mellom Share-FI og ganghastigheit, tal på medikament, tal på diagnosar og sjølvrapportert helse (p-verdiar < 0,05).
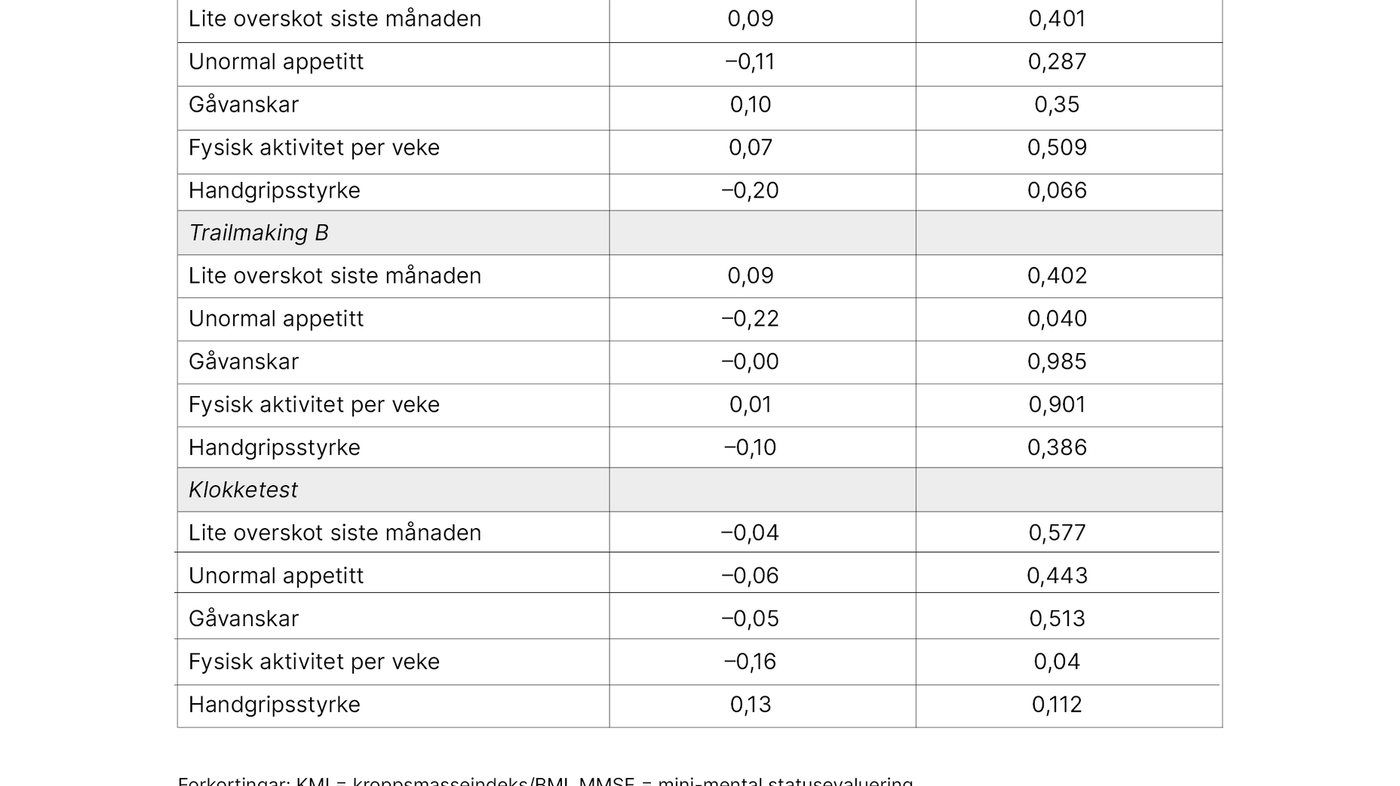
Vi undersøkte vidare assosiasjonar mellom einskildkomponentar i Share-FI og testar for kognisjon (tabell 3). Av einskildkomponentane i Share-FI var låg fysisk aktivitet assosiert med dårlegare skår på MMSE og klokketest, medan nedsett appetitt var assosiert med dårlegare skår på Trailmaking B, men korrelasjonane var små til moderate.
Diskusjon
Studien viser ingen signifikante assosiasjonar mellom Share-FI-sumskår og MMSE, Trailmaking A og B og klokketest. Einskildkomponentar i Share-FI som låg fysisk aktivitet var assosiert med dårlegare skår på MMSE og klokketest, medan unormal appetitt var assosiert med dårlegare skår på Trailmaking B, men korrelasjonane var små til moderate.
Sensitivitetsanalysane viste betydelege korrelasjonar mellom Share-FI og variablar som i størst grad reflekterte fysiske helseaspekt, noko som tyder på at deltakarene i studien i rimeleg grad forstod og svarte korrekt på spørsmåla i Share-FI.
Tidlegare forsking og våre funn tyder på at Share-FI er eigna til å avdekke fysisk skrøpelegheit (13, 29). Men det primære med denne studien var om Share-FI er eigna til å avdekke skrøpelegheit hjå eldre dersom ein vil ta omsyn til kognisjon. Internasjonal forsking peikar på at kognitiv svikt bør inngå i omgrepet skrøpelegheit (10, 17, 30–32). Handajani og medarbeidarar drøfter samanhengen mellom skrøpelegheit og kognisjon og stiller spørsmål ved om kognitiv svikt er ein konsekvens av, eit symptom på, eller ein pådrivar av skrøpelegheit (33).
Share-FI er eit mykje brukt verktøy for å kartlegge skrøpelegheit (13, 29, 32) og er bygd opp som ein fleirdimensjonal indeks, som er kjenneteikna av at ulike variablar peikar mot eit felles omgrep, her skrøpelegheit. Summen av variablane kan samla vise at personen ikkje er skrøpeleg, men fortel nødvendigvis ikkje så mykje om enkeltvariablane. Det vil seie at sumskåren kan vere bra, men fortel ikkje om ein mogleg dårleg skår på ein enkeltvariabel.
Forskarar har trekt fram at Share-FI kan vere krevjande å gjennomføre, særleg for personar med kognitiv svikt (33). Det er mogleg å få hjelp av pårørande til å fylle ut skjemaet, men dei sjølvrapporterte svara kan likevel vere upålitelege (13).
Tabell 1 viser at pasientar som ikkje er klassifiserte som skrøpelege, generelt skårar betre når det gjeld opplevd overskot og fysisk aktivitet. Desse funna samsvarer med Danilovich og medarbeidarar (14), som fann at Share-FI skil godt mellom skrøpeleg og ikkje-skrøpeleg på fysisk funksjon.
Gruppa pre-skrøpeleg, derimot, vil ifølgje Danilovich ha behov for ei breiare vurdering. Korkje Danilovich eller Romero-Ortuno (13) har med kognitiv vurdering i forskinga si. Det kan støtte opp om tvilen ein sit igjen med etter bruk av Share-FI i praksis. Tvilen ligg ikkje på samanhengen mellom kognitiv funksjon og skrøpelegheit, men kva verktøy som er best eigna for å avdekke skrøpelegheit.
Share-FI bygger hovudsakleg på sjølvrapporterte data og kan vere forbunde med målefeil. Det kan vere ei plausibel forklaring på at ein ikkje fann samanheng mellom Share-FI-sumskår og kognitive testar i studien vår. Dei fleste pasientane som kjem til poliklinikken, har byrjande kognitiv svikt (tabell 1), mellom anna kjenneteikna av nedsett hukommelse og vanskar med tidsperspektiv (21).
Svara frå pasientane kan vere prega av slik livet var før, ikkje der dei er nå. Sjølvrapportering kan gje mindre nøyaktigheit, særleg hjå personar med kognitiv svikt (13, 16). Ein kan i tillegg spørje seg om apati i form av manglande initiativ, motivasjon og interesse kan medføre at personar kan ha tanke om å sette i gang aktivitetar utan å utføre dei i praksis (21, s. 253).
Ein annan mogleg målefeil kan vere overrapportering av fysisk funksjon og aktivitet frå pasientane (15, 34). Dei siste åra er brukarperspektivet trekt meir inn i forsking rundt skrøpelegheit, og Kojima og medarbeidarar (5) fann at enkelte kan oppleve det negativt å bli omtalt som skrøpelege og kjenne seg stigmatiserte av dette.
Analyse av enkeltkomponentar og Share-FI viste større utslag i forhold til kognitive testar i studien vår enn sumskår. Med bakgrunn i dette kan ein hevde at funn av samanhengar mellom enkeltvariablar i Share-FI og kognitive testar i studien er noko ein kan studere vidare.
Ein styrke ved studien er at registeret har adekvat utvalstorleik og nyttar validerte målemetodar. Alle pasientar som kom til poliklinikken, fekk spørsmål om deltaking. Utvalet består derimot av pasientar som er under utgreiing og tilvist til geriatrisk poliklinikk av fastlege. Det er variasjon mellom fastlegar for tilvisingsrate til poliklinikk. Poliklinikken ligg i Sogn og Fjordane, som har ein klassisk rural populasjon, og det er ikkje sikkert ein vil få akkurat dei same resultata i ein annan populasjon. Det at pasientane var assistert av geriatrisk sjukepleiar ved utfylling av Share-FI, gjer at ein må vere varsam med å samlikne med studiar der ein ikkje fekk slik assistanse.
Vi nytta vidare ein tverrsnittstudie som gjer at vi berre har eitt måletidspunkt, og kan difor ikkje seie noko om årsak og verknad. Det manglar ein del data på variablane «Trailmaking A og B» som skuldast at dette berre blir utført på eit utval av pasientane, gjerne i samband med førarkortvurdering. Manglande data på «ganghastigheit» skuldast at denne testen vart innført undervegs i prosjektet. Resultata knytt til desse variablane må difor tolkast med litt varsemd.
Det er brei einigheit om viktigheita av å kartlegge skrøpelegheit hjå eldre personar, og mange verktøy er utarbeidd, men det er ingen konsensus om kva som er det best eigna verktøyet (2, 4, 5). På bakgrunn av funn frå denne studien stiller ein spørsmål ved bruk av sjølvrapportering som verktøy for å avdekke skrøpelegheit hjå personar med kognitiv svikt. Enkeltkomponentar i Share-FI i lag med kognitive testar kan gje ein peikepinn på skrøpelegheit.
Eldre personar er ei heterogen gruppe, og for å fange opp personar som er i ferd med å utvikle skrøpelegheit, gjev objektive målingar sikrast data. Brei geriatrisk vurdering for åkartlegge skrøpelegheit er mykje brukt (4), men kritisert fordi den er tidkrevjande i praksis. Eit verktøy for å avdekke skrøpelegheit bør vere påliteleg og enkelt i bruk i klinisk praksis (5, 35).
Konklusjon
Studien viste ingen samanheng mellom totalskår for skrøpelegheit målt med Share-FI og kognitive testar. Samla sett gir studien ikkje haldepunkt for at Share-FI er godt eigna for å kartlegge skrøpelegheit dersom ein vil ta omsyn til kognisjon.
Forfatterne oppgir ingen interessekonflikter.
Åpen tilgang CC BY 4.0.
Hva studien tilfører av ny kunnskap
Lagt til fjerdeforfatter: Eva Herløsund Søgnen (04.05.2023).






















0 Kommentarer